Elektrolysator
Elektrolyse er et kemisk-fysisk fænomen ved nedbrydning af stoffer i grundstoffer ved hjælp af en elektrisk strøm, som bruges overalt til industrielle formål. På basis af denne reaktion fremstilles aggregater til opnåelse af for eksempel chlor eller ikke-jernholdige metaller.

Elektrolyseanlæg, der består af plader
Den konstante vækst i priserne på energiressourcer har gjort ioniske installationer til hjemmebrug efterspurgt. Hvad er sådanne strukturer, og hvordan man laver dem derhjemme?
Generel information om elektrolysatoren
Et elektrolyseanlæg er en anordning til elektrolyse, der kræver en ekstern energikilde, som strukturelt består af flere elektroder, der placeres i en beholder fyldt med elektrolyt. Denne installation kan også kaldes en vanddelende enhed.
I lignende enheder betragtes produktivitet som en vigtig teknisk parameter, hvilket betyder volumen af brint produceret pr. Time og måles i m3 / h. Stationære enheder bærer en sådan parameter i modelens navn, for eksempel danner SEU-40-membranenheden 40 kubikmeter i timen. m brint.


ekstern visning af den stationære industrienhed SEU-40
Andre egenskaber ved sådanne enheder afhænger fuldstændigt af det tilsigtede formål og installationstypen. For eksempel afhænger effektiviteten af enheden af følgende indikatorer, når der udføres elektrolyse af vand:
- Niveauet for det laveste elektrodepotentiale (spænding). For at enheden fungerer korrekt, skal denne egenskab være i området 1,8-2 V pr. Plade. Hvis strømforsyningen har en spænding på 14 V, giver kapaciteten i den elektrolytiske celle med elektrolytopløsningen mening at opdele arkene i 7 celler. En lignende installation kaldes en tør celle. En mindre værdi starter ikke elektrolyse, og en større værdi vil i høj grad øge energiforbruget;
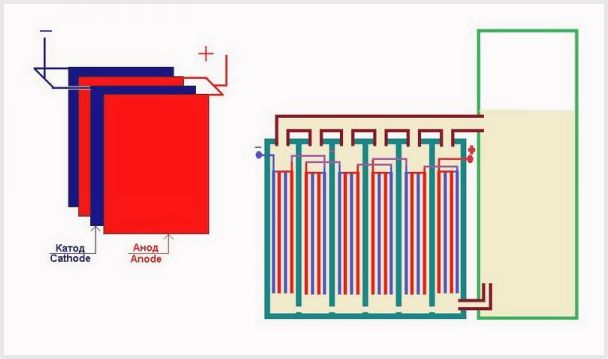

Placering af plader i et elektrolyseanlægs bad
- Jo mindre afstanden mellem pladeelementerne er, desto mindre vil modstanden være, hvilket, når en stor strøm passerer, fører til en stigning i produktionen af gasformigt materiale;
- Pladernes overfladeareal påvirker direkte produktiviteten;
- Varmebalance og grad af elektrolytkoncentration;
- Materiale af elektrodekomponenter. Guld betragtes som et dyrt, men vidunderligt materiale til brug i elektrolytiske celler. På grund af de høje omkostninger bruges rustfrit stål undertiden.
Det vigtigste! I konstruktioner af en anden type vil værdierne have forskellige parametre.
Vandelektrolyseanlæg kan også bruges til formål såsom dekontaminering, oprensning og vandkvalitetsvurdering.
Opnåelse af brint i laboratoriet
Den moderne laboratoriemetode til produktion af brint adskiller sig ikke fra den, hvormed den blev opnået af Henry Cavendish. Dette er reaktionerne fra metaller med syrer. I laboratoriet opnås brint i apparatet Kippa (Figur 152).
Kipp apparater lavet af glas og består af flere dele:
- reaktionskolbe med reservoir;
- tragt med et langt rør
- gasudløbsrør.
Reaktionskolben har en øvre sfærisk del med en åbning, hvori et gasudløbsrør udstyret med en hane eller en klemme er indsat, og et nedre reservoir i form af en halvkugle. Det nedre reservoir og reaktionskolben er adskilt af en gummi- eller plastpakning med et hul, gennem hvilket et langt tragtrør strækker sig ind i det nedre reservoir og når næsten til bunden. Tørstof (marmor, zink) hældes på pakningen gennem sidehullet med en spatel.Hullet lukkes med et stik med et gasudløbsrør. Derefter hældes syreopløsningen, når hanen eller klemmen er åben, i den øverste tragt. Når væskeniveauet når stoffet på pakningen, begynder en kemisk reaktion med frigivelse af gas. Når ventilen er lukket, tvinger trykket fra den udviklede gas væsken ud af reaktoren ind i toppen af tragten. Reaktionen stopper. Åbning af vandhanen fører til genoptagelse af reaktionen. Anbring zinkstykkerne i reaktionskolben. Vi bruger svovlsyre som syren. Ved kontakt med zink og svovlsyre forekommer følgende reaktion:
Zn + H2SO4 = ZnSO4 + H2
Du kan fylde en sæbeboble med brint.
For at gøre dette er det nødvendigt at sænke røggasrøret ned i en sæbevand. I slutningen af røret begynder der at dannes en brintfyldt sæbeboble; over tid bryder boblen af og flyver opad, hvilket beviser brintens lethed. Lad os samle det udviklende brint... I betragtning af at brint er meget lettere end luft, for at opsamle brint, skal beholderen, hvor gassen opsamles, placeres på hovedet, eller det skal opsamles ved at fortrænge vand. Hvordan detekteres brint? Fyld røret med brint, hold det på hovedet i forhold til gasudløbsrøret. Vi bringer reagensglas med et hul til åndelampens flamme - en karakteristisk pop høres.
Bomuld - Dette er et tegn på, at reagensglas indeholder brint. Når reagensglasset bringes op til en flamme, reagerer brint med ilt i luften. I små mængder ledsages reaktionen af ilt og brint af en pop. Flere detaljer om denne reaktion vil blive drøftet i det næste afsnit.
Arbejdsprincip og typer af elektrolysator
En meget enkel enhed har elektrolysatorer, der deler vand i ilt og brint. De består af en beholder med en elektrolyt, hvori elektroderne er placeret, forbundet med en energikilde.
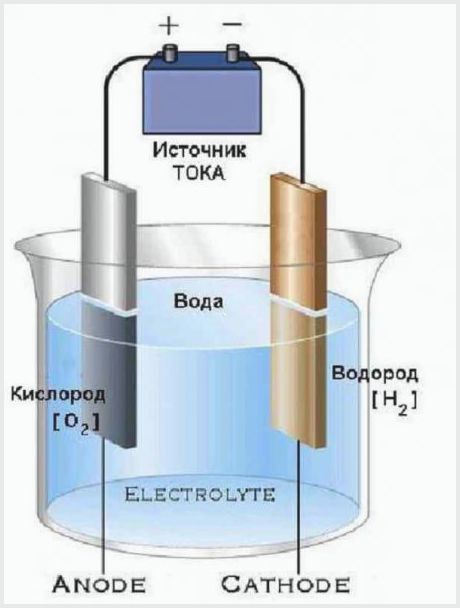

Designet af det enkleste elektrolyseanlæg
Arbejdsprincippet for et elektrolyseanlæg er, at den elektriske strøm, der passerer gennem elektrolytten, har en spænding, der er tilstrækkelig til at nedbryde vand i molekyler. Resultatet af processen er, at anoden frigiver en del ilt, og katoden skaber to dele brint.
Elektrolyse af vand i industrielle brintgeneratorer
Elektrolyse
det er en redox-reaktion, der kun finder sted under påvirkning af elektricitet. I industrielle brintgeneratorer udføres elektrolyse af vand for at opnå brint og ilt. For at reaktionen kan fortsætte, skal to elektroder placeres i elektrolytten, forbundet med en jævnstrømskilde:
- Anode
- elektrode, som den positive leder er forbundet med - Katode
- elektroden, som den negative leder er tilsluttet.
Nedenfor er et skematisk diagram over en industriel alkalisk elektrolyser.
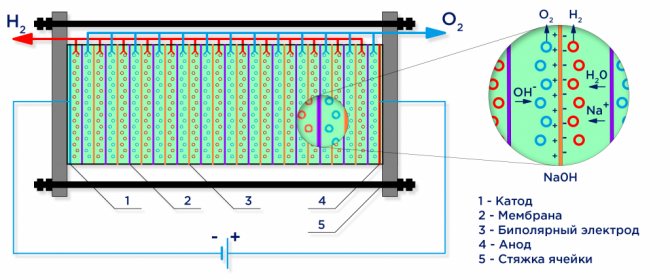

Vandelektrolyse
Under påvirkning af en elektrisk strøm opdeles vand i dets bestanddele: brint og ilt. En negativt ladet katode tiltrækker brintkationer, og en positivt ladet anode tiltrækker OH-anioner.
Demineraliseret vand, der anvendes i industrielle elektrolyseanlæg, er i sig selv en svag elektrolyt, så der tilsættes stærke elektrolytter for at øge ledningsevnen af den elektriske strøm. Ofte vælges elektrolytter med et lavere kationisk potentiale for at udelukke konkurrence med hydrogenkationer: KOH eller NaOH. Den elektrokemiske reaktion, der finder sted på elektroderne, er som følger:
- Anodereaktion: 2H2O → O2
+ 4H + + 4e− - iltudvikling; - Katodereaktion: 2H2O + 2e− → H2
+ 2OH− - brintudvikling.
En industriel elektrolysator er samlet i henhold til et bipolært skema, hvor bipolare "mellemliggende" elektroder med forskellige ladninger på siderne er placeret mellem hovedelektroden og katoden.På siden af hovedanoden har den mellemliggende elektrode en katodeside på siden af katoden - en anodeside (se figur).
For at opnå rent brint og ilt er det endvidere nødvendigt at adskille de gasser, der dannes på elektroderne, og til dette anvendes separationsionbyttermembraner (se figur). Mængden af produceret brint er dobbelt så stor som den producerede ilt, og derfor stiger trykket i brinthulrummet dobbelt så hurtigt. For at udligne trykket i hulrummene anvendes en trykudligningsmembran ved udløbet af elektrolysatoren, hvilket forhindrer brint, der klemmer sig ind i ilthulrummet gennem kanalerne beregnet til elektrolytcirkulation.
Denne metode er den mest anvendte metode i branchen og giver dig mulighed for at opnå gasformigt brint med en effektivitet på 50 til 70% med en kapacitet på op til 500 m3 / h ved et specifikt energiforbrug på 4,5-5,5 N2m3 / kWh.
ELEKTROLYSE PÅ TPE
I øjeblikket er den mest effektive separationsmetode elektrolyse ved anvendelse af faste polymerelektrolytter baseret på en perfluoreret ionbyttermembran.
Denne type elektrolyser tillader brintproduktion med en effektivitet på op til 90% og er den mest miljøvenlige. Elektrolysatorer med TPE er 6-7 gange dyrere end alkaliske og er derfor endnu ikke blevet udbredt i industrien.
Typer af elektrolysatorer
Enheder til opdeling af vand er af følgende typer:
Sådanne elektrolysatorer har det mest primitive design (billedet ovenfor). De er kendetegnet ved det kendetegn, at manipulation med antallet af celler giver dig mulighed for at drive enheden fra en kilde med en hvilken som helst spænding.
Flydende udsigt
Disse installationer har i deres eget design et badekar fuldstændigt fyldt med elektrolyt med elektrodeelementer og et reservoir.
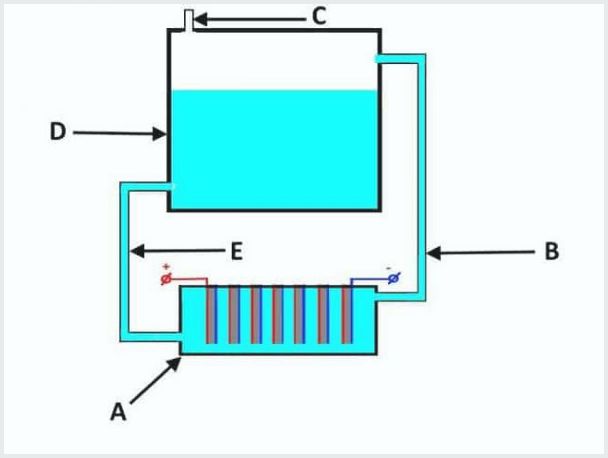

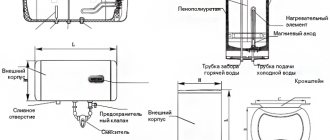
Indretningen i en konventionel gennemstrømningselektrolysator, hvor A er et bad med elektroder, D er en tank, B, E er rør, C er en udløbsventil
Arbejdsprincippet for gennemstrømningselektrolyseanlægget er som følger (fra billedet ovenfor):
- når elektrolyse lækker, presses elektrolytten ud samtidigt med gassen gennem røret "B" i tanken "D";
- i tank "D" processen med gasseparation fra elektrolytstrømme;
- gas udtræder gennem ventilen "C";
- elektrolytopløsningen strømmer tilbage gennem røret "E" til badet "A".
Interessant at vide. Dette funktionsprincip er sat op i visse invertermaskiner - ved forbrændingen af den frigivne gas kan delene svejses.
Membranudsigt
Et elektrolyseanlæg af membrantype har samme design som andre elektrolysatorer, men elektrolytten er et polymerbaseret fast stof kaldet membranvæv.
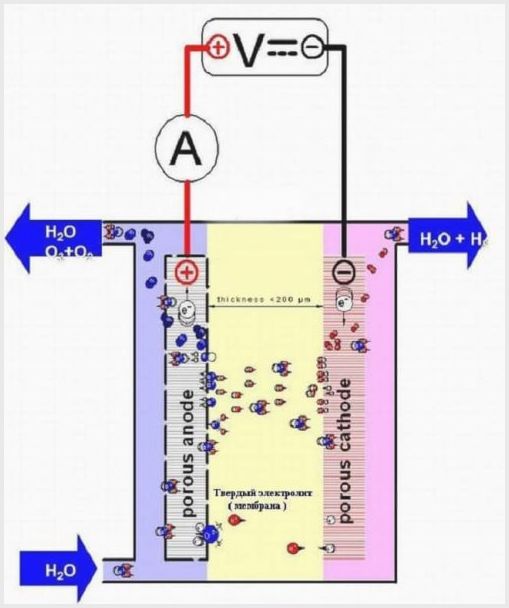

Membrancelle design
Membranvævet i sådanne aggregater har et dobbelt formål - overførsel af ioner og protoner, zonering af elektroder og elektrolyseprodukter.
Membranbillede
Når det ene stof ikke kan trænge ind og påvirke det andet, anvendes en porøs membran, som kan være lavet af glas, polymerfibre, keramik eller asbestmateriale.
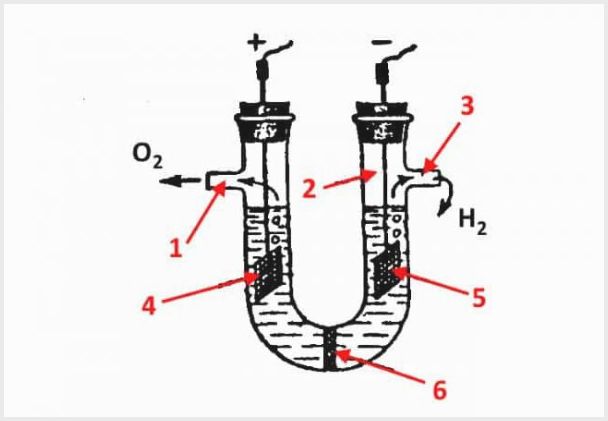

Enheden til en membranelektrolysator, hvor 1 er et udløb for ilt, 2 er en kolbe, 3 er et udløb for hydrogen, 4 er en anode, 5 er en katode, 6 er en membran
Alkalisk
Elektrolyse kan ikke finde sted i destilleret vand. I sådanne tilfælde er det nødvendigt at bruge katalysatorer, som er alkaliske opløsninger med høj koncentration. Baseret på dette kan en væsentlig del af ioniske enheder kaldes alkalisk.
Det vigtigste! Det skal bemærkes, at anvendelsen af salt som en katalysator er skadelig, da chlorgas frigives i løbet af reaktionen. Som regel fungerer natriumhydroxid som en vidunderlig katalysator, som ikke korroderer metalelektroder og ikke bidrager til frigivelsen af skadelige stoffer.
Selvfremstillet elektrolysator
Alle kan lave en elektrolysator med egne hænder. Til samlingsprocessen af det mest almindelige design er følgende materialer nødvendige:
- rustfrit stålplade (de bedste muligheder er udenlandske AISI 316L eller vores 03X16H15M3);
- bolte М6х150;
- skiver og møtrikker;
- gennemsigtigt rør - du kan bruge et vaterpas, der bruges til konstruktionsformål;
- flere fiskebeslag med en udvendig diameter på 8 mm;
- en plastbeholder med et volumen på 1,5 liter;
- et lille filter, der filtrerer ledningsvand, for eksempel et filter til vaskemaskiner;
- returventil.
Samlingsproces
Saml elektrolysatoren med dine egne hænder i henhold til følgende instruktioner:
- Først og fremmest skal du markere og den efterfølgende savning af rustfrit stålplade i identiske firkanter. Savning kan udføres med en vinkelsliber (vinkelsliber). Et af hjørnerne i sådanne firkanter skal skæres i en vinkel for korrekt fastgørelse af pladerne;
- Derefter skal du lave et hul til bolten på siden af pladen modsat hjørnesavskæringen;
- Forbindelsen af pladerne skal ske efter tur: en plade på "+", den næste på "-" og så videre;
- Mellem de forskellige ladede plader skal der være en isolator, der fungerer som et rør fra vaterpas. Det skal skæres i ringe, som skal skæres i længderetningen for at opnå strimler med en tykkelse på 1 mm. Denne afstand mellem pladerne er tilstrækkelig til god gasudvikling under elektrolyse;
- Pladerne fastgøres sammen ved hjælp af skiver som følger: en skive sidder på bolten, derefter en plade, derefter tre skiver efter en plade osv. Plader, der er positivt ladede, placeres i et spejlbillede af negativt ladede ark. Dette gør det muligt at forhindre, at de savede kanter berører elektroderne;


Plader af elektrolyseanlægget samlet
- Når du monterer pladerne, skal du isolere dem samtidigt og stramme møtrikkerne;
- Hver plade skal også ringes for at være sikker på, at der ikke er nogen kortslutning;
- Desuden skal hele samlingen placeres i en plastikæske;
- Derefter er det værd at fremhæve de steder, hvor boltene berører beholdervæggene, hvor du borer to huller. Hvis boltene ikke passer ind i beholderen, skal de skæres med en stiksav;
- Derefter strammes boltene med møtrikker og skiver for at stramme strukturen;


Plader anbragt i en plastikbeholder
- Efter de udførte trin skal du lave huller i beholderlåget og indsætte beslagene i dem. Uigennemtrængelighed i dette tilfælde kan sikres ved at forsegle samlingerne med silikonebaserede fugemasser;
- En sikkerhedsventil og et filter i strukturen er placeret ved udløbet af gassen og fungerer som et middel til at kontrollere overdreven ophobning af gas, hvilket kan føre til dårlige resultater;
- Elektrolyseenheden er samlet.
Den sidste fase er en test, der udføres på en lignende måde:
- fylde beholderen med vand op til mærket for boltene til fastgørelseselementer;
- tilslutning af strøm til enheden
- forbindelse til rørets montering, hvor den modsatte ende sænkes ned i vandet.
Hvis der påføres en svag strøm på installationen, vil frigivelsen af gas gennem røret næsten være umærkelig, men det vil være muligt at se det inde fra elektrolysatoren. Ved at øge vekselstrømmen, tilsætte en alkalisk katalysator til vandet, er det muligt at øge udbyttet af det gasformige stof betydeligt.
Den fremstillede elektrolysator er som regel en vigtig del af mange enheder, for eksempel en brintbrænder.


udseendet af en hydrogenbrænder, hvis basis betragtes som en selvfremstillet elektrolysator
Kendskab til typer, nøglekarakteristika, enhed og funktionsprincip for ioniske installationer, kan du udføre den korrekte samling af en hjemmelavet struktur, som er en fremragende assistent i en række hverdagssituationer: fra svejsning og besparelse af motorkøretøjers brændstofforbrug til funktion af varmesystemer.
Gør elektrolysøren med dine egne hænder
Du er helt sikkert bekendt med elektrolyseprocessen fra grundskolens læseplan. Dette er når 2 polære elektroder placeres i vandet under strøm for at opnå metaller eller ikke-metaller i deres rene form. En elektrolysator er nødvendig for at nedbryde vandmolekyler i ilt og brint. Elektrolysatoren deler som en del af videnskabelige mekanismer molekyler i ioner.
Der er to typer af denne enhed:
- Tør elektrolysator (dette er en helt lukket celle);
- Våd elektrolysator (disse er to metalplader anbragt i en beholder med vand).
Denne enhed er enkel med hensyn til enheden, hvilket gør det muligt at brug selv derhjemme... Elektrolysatorer opdeler elektrolyseladningerne for molekylernes atomer i ladede atomer.
I vores tilfælde deler det vand i positivt brint og negativt ilt. For at gøre dette kræves en stor mængde energi, og for at gøre mindre af den krævede mængde energi anvendes en katalysator.
Brintproduktion ved elektrolyse af vand
At opnå rent brint ved elektrolyse af vand er den mest åbenlyse og effektive teknologi og en af de mest lovende måder at opnå alternative brændstoffer på. Brint ekstraheres fra enhver vandig opløsning, og når det brændes, omdannes det tilbage til vand.
Sammenlignet med andre metoder til brintproduktion har vandelektrolyse en række fordele. For det første anvendes tilgængelige råmaterialer - demineraliseret vand og elektricitet. For det andet er der ingen forurenende emissioner under produktionen. For det tredje er processen fuldt automatiseret. Endelig er output et ret rent (99,99%) produkt. Af alle elektrolysemetoder betragtes elektrolyse ved høj temperatur som den mest lovende (omkostningerne ved brint er fra $ 2,35 til $ 4,8 / kg). Det bør være teknologisk bevæbnet, da det under visse økonomiske forhold kan bruges i stor skala industriel skala.
Vandelektrolyse er en fysisk-kemisk proces, hvor destilleret vand nedbrydes til ilt og brint under påvirkning af en konstant elektrisk strøm. Som et resultat af adskillelsen af vandmolekyler i dele opnås hydrogen dobbelt så meget som ilt. Effektiviteten ved elektrolyse er sådan, at der opnås ca. en kubikmeter af begge gasser fra 500 ml vand til en pris på ca. 4 kW / h elektrisk energi.
Processstrømmen til elektrolyse af vand til opnåelse af brint og ilt opnås som regel ved hjælp af en industriel ensretter med de krævede driftsparametre. Normalt er denne spænding op til 90V og strømstyrke op til 1500 A. En passende enhed er Pulsar SMART.
På den elektroniske visning af ensretteren Pulsar SMART eller i speciel software til en computer kan du styre alle faser af produktionsprocessen, som giver operatøren mulighed for at overvåge parametrene og logge fremskridtene i den teknologiske proces døgnet rundt. Fuldautomatisk drift inklusive kontinuerlig overvågning af alle parametre til problemfri drift uden operatørovervågning. Alle spændings- og strømparametre måles og kontrolleres konstant af ensretterens mikroprocessor. Desuden er alle overvågede parametre rettet af en enhed, som i tilfælde af en fejl eller afvigelse automatisk kan stoppe processen og signalere dette ved hjælp af en lyssøjle.
Ensrettere i Pulsar SMART-serien er designet i overensstemmelse med de højeste industrielle effektivitetskrav og internationale standarder. Samtidig tillader den teknologiske software fleksibel tilpasning til kundens krav og forbedres konstant.
Vi opretter en enhed med vores egne hænder
Enheden til denne proces kan gøres manuelt.
Til dette har du brug for:
- Rustfrit stålplade;
- Bolte M6 x 150;
- Skiver;
- Nødder;
- Transparent rør;
- Forbindelseselementer med gevind på begge sider;
- En og en halv liter plastbeholder;
- Vandfilter;
- Kontroller ventilen for vand.
En fremragende mulighed for rustfrit stål er AISI 316L fra en udenlandsk producent eller 03X16H15M3 fra en producent fra vores land. Der er absolut ingen grund til at købe rustfrit stål, du kan tage det gamle. 50 til 50 centimeter er nok for dig.
"Hvorfor tage rustfrit stål i sig selv?" - du spørger. Da det mest almindelige metal korroderer. Rustfrit stål tåler alkalier bedre. Skulle gerne skitsere arket på en sådan måde, at det opdeles i 16 lignende firkanter... Du kan skære den med en vinkelsliber. Skær et af hjørnerne i hver firkant.
På den anden side og det modsatte hjørne, fra det savede hjørne, bor et hul til en bolt, der hjælper med at holde pladerne sammen. Elektrolysatoren holder ikke op med at arbejde sådan:t pladens strøm strømmer til pladen - og vand nedbrydes til ilt og brint. Takket være dette har vi brug for en god og negativ plade.
Plader skal tilsluttes skiftevis: plus-minus-plus-minus, med en lignende metode, vil der være en stærk strøm. For at isolere pladerne en fra en anvendes et rør. En ring er skåret fra niveauet. Ved at skære det får vi en strimmel millimeter tyk. Denne afstand er mere korrekt til fremstilling af gas.
Pladerne er forbundet med skiver: vi lægger en skive på bolten, derefter en plade og tre skiver, derefter en plade igen og så videre. På plus og minus skal du sætte otte plader. Hvis alt er gjort korrekt, vil pladens udskæringer ikke røre elektroderne.
Derefter skal du stramme møtrikkerne og isolere pladerne. Derefter placerer vi strukturen i en plastikbeholder.
Fejlfinding og test af enheden
Derefter er det nødvendigt at bestemme, hvor boltene berører boksens vægge og på disse steder bore to huller. Hvis det uden nogen åbenbar grund viser sig, at boltene ikke passer ind i beholderen, skal de gøre det klip og stram for at blive tæt med møtrikker... Nu skal du bore dækslet ud og indsætte gevindstikkene der fra begge sider. For at sikre uigennemtrængelighed skal fugen forsegles med et silikonebaseret fugemasse.
Når du har samlet din egen elektrolysator med dine egne hænder, skal du teste den. For at gøre dette skal du slutte enheden til en strømkilde, fyld den med vand til boltene, sæt låget på ved at forbinde et rør til beslaget og sænke den modsatte ende af røret i vandet. Hvis strømmen er svag, vil strømmen være synlig inde fra elektrolysatoren.
Forøg gradvist strømmen i dit hjemmelavede apparat. Destilleret vand leder ikke elektricitet godt, fordi det ikke indeholder salte eller urenheder. For at forberede elektrolytten er det nødvendigt at tilsætte alkali til vandet. For at gøre dette skal du tage natriumhydroxid (indeholdt i "Mole" -rørrensere). En sikkerhedsventil er nødvendig for at forhindre, at en anstændig mængde gas akkumuleres.
- Det er bedre at bruge destilleret vand og sodavand som katalysator.
- Du skal blande noget bagepulver med fyrre dele vand. Væggene på siderne er bedst lavet af akrylglas.
- Elektroderne er bedst lavet af rustfrit stål. Det giver mening at bruge guld til plader.
- Brug gennemsigtig PVC til bagside. De kan være 200 x 160 millimeter store.
- Du kan bruge din egen elektrolyser, lavet af dig selv, til at tilberede mad til fuldstændig forbrænding af benzin i biler og i de fleste tilfælde.
Tørre elektrolysatorer bruges hovedsageligt til maskiner. Generatoren øger forbrændingsmotorens effekt. Brint antænder meget hurtigere end flydende brændstof, hvilket giver mere stempelkraft. Ud over muldvarp kan du tage Mister Muscle, kaustisk soda, bagepulver.
Generatoren fungerer ikke på drikkevand.Det er bedre at forbinde elektricitet som denne: den første og den sidste plade - minus og på pladen i midten - plus. Jo større areal på pladerne og jo stærkere strøm, jo mere gas frigives.
DIY hjemmelektrolyse
Da jeg var lille, ville jeg altid gøre noget selv med mine egne hænder. Men forældre (og andre pårørende) tillod normalt ikke dette. Og jeg så ikke (og kan stadig ikke se) noget galt, når små børn vil lære